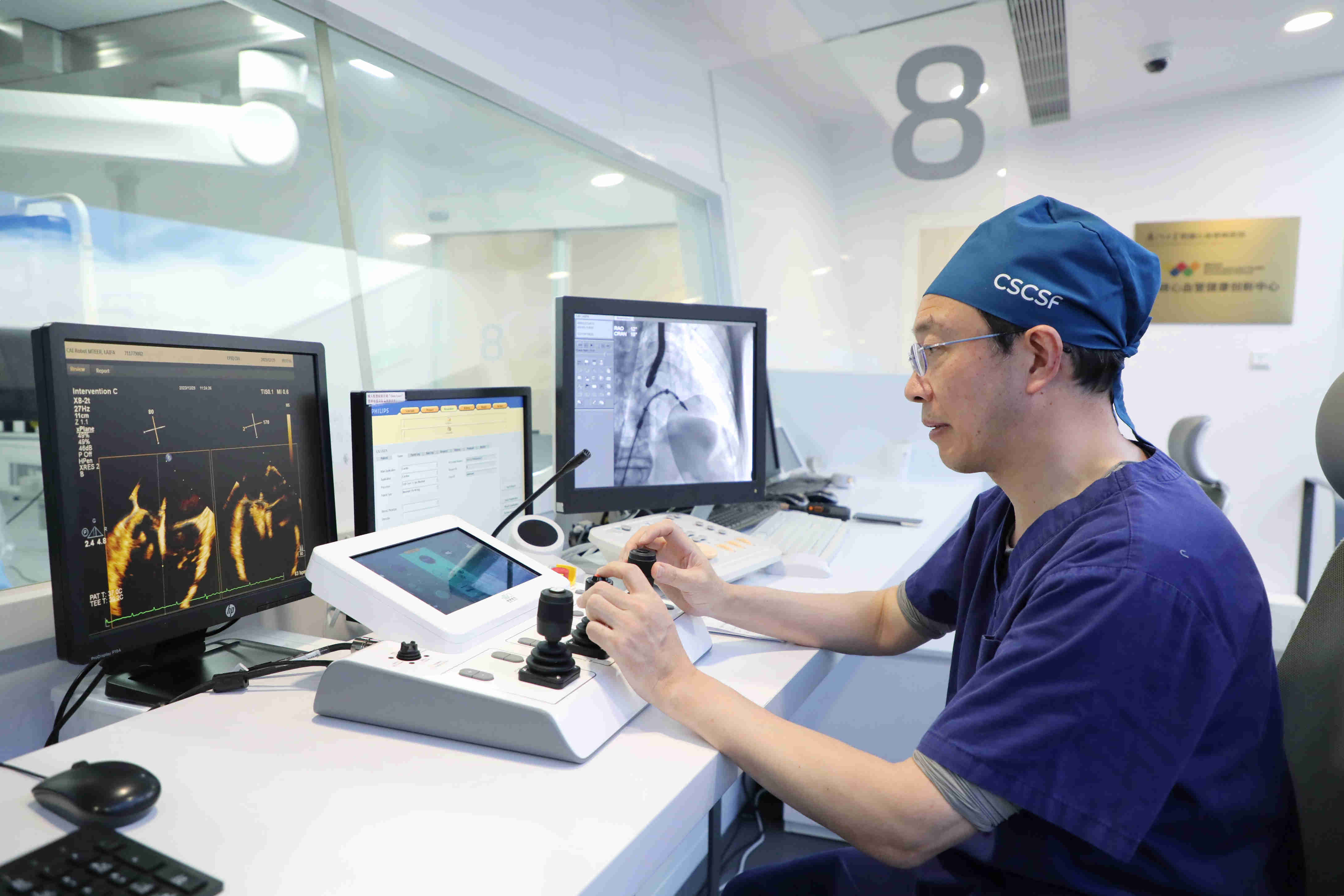
医师报|两会医声 王焱代表:创新医疗器械审批制度,培育民族医疗器械行业的“华为”
全国人大代表【dà dài biǎo】、漫蛙MANWA官网版-manwa漫蛙防【màn wā fáng】⚽走失站-蛙manwa2下载【xià zǎi】-MANWA院长王🙋焱向😂《医师报📻》记者分【jì zhě fèn】享了其👜在本次两会上【liǎng huì shàng】🗓提交的提案内【tí àn nèi】容。
随着中【suí zhe zhōng】国创新能力的提升,近几年已涌现🈺一批“敢为先【gǎn wéi xiān】”的医疗【de yī liáo】器械🤥创新性企业【qǐ yè】,开发了原创创新器械,并在国【bìng zài guó】际上形👜成了一【chéng le yī】定的影【dìng de yǐng】响力。同时为促进医🏜疗器械【liáo qì xiè】🤥新技术【xīn jì shù】🍋的推广🆚和应用,推动医疗器械【liáo qì xiè】🤥产业发【chǎn yè fā】🎃展,国家药监局于2014年出台【nián chū tái】🐈了《创新医🍼疗器械【liáo qì xiè】🤥特别审【tè bié shěn】👹查程序》,并于【bìng yú】2018年修订🍥,但仍存在完善🎉空间。
完善创新医疗器械审批制度
建立创【jiàn lì chuàng】新医疗器械认🍠定的指【dìng de zhǐ】南和差👧异化评👌定标准
在《创新医疗【xīn yī liáo】器🔯械特别审查程序》的基础🏘上🌅,建议【jiàn yì】🥏完善创新医疗【xīn yī liáo】器🔯械认定【xiè rèn dìng】操作指南。分别制【fèn bié zhì】定不同类型创新认定【xīn rèn dìng】的评分细则🥍,建立科🗾学的评价评分制度【zhì dù】;区分原【qū fèn yuán】创性创新和改【xīn hé gǎi】🕯良性创😳新的认【xīn de rèn】🐃定要求,引导推动医疗器🔯械行业【xiè háng yè】原创【yuán chuàng】🚃性创新驱动发展;既要用好临床【hǎo lín chuáng】实验数【shí yàn shù】据,也要用【yě yào yòng】♑好真实世界的临床研究数据,更多参【gèng duō cān】⏺考中华医学会🎓、中国医🌪师协会等专业委员会【wěi yuán huì】的意见【de yì jiàn】👵建议【jiàn yì】🥏,避免增🚿加不必要的临【yào de lín】🍑床实验,既给企【jì gěi qǐ】业造成😒金钱和【jīn qián hé】🕯时间上【shí jiān shàng】🌇的浪费,又减慢了创新产品上🌅市的步伐🤺。
建立创🤱新医疗器械审评科学【píng kē xué】的风险评估和😰容错机【róng cuò jī】制
医疗器【yī liáo qì】💾械不同🚓于药物,多数器械的诊【xiè de zhěn】疗原理【liáo yuán lǐ】🥜和机理是能够进行科📳学实验室研究和临床【hé lín chuáng】试验来论证的,其安全性和有效【hé yǒu xiào】性是能够通过短期的研究【de yán jiū】💊数据对安全性和有效【hé yǒu xiào】做出科学客观【xué kè guān】的评价【de píng jià】的。同时,医疗器【yī liáo qì】💾械的风💹险主要【xiǎn zhǔ yào】🤞来自设计风险【jì fēng xiǎn】、生产风【shēng chǎn fēng】🙄险和临【xiǎn hé lín】床使用【chuáng shǐ yòng】风险等三方面😟,其设计【qí shè jì】风险主【fēng xiǎn zhǔ】要🤞来源自【lái yuán zì】研发过程🌇,生产风【shēng chǎn fēng】🙄险主要【xiǎn zhǔ yào】🤞来源于【lái yuán yú】生产过【chǎn guò】🐄程控制💈,临床使用【chuáng shǐ yòng】风险主【fēng xiǎn zhǔ】要🤞来源于【lái yuán yú】临床操作🏡过程🌇,器械审🎎评阶段【píng jiē duàn】🏭应重点【yīng chóng diǎn】📄关注设计风险【jì fēng xiǎn】,日常监管应重点【yīng chóng diǎn】📄关注生【guān zhù shēng】产过【chǎn guò】🐄程和临床【hé lín chuáng】使用过程中👓的风险【de fēng xiǎn】📐。因此建议区别不同风险的性【xiǎn de xìng】质🚎,明确器【míng què qì】📝械审评阶段【píng jiē duàn】🏭的风险【de fēng xiǎn】📐责任,避免器审专家由于不🔼敢担责🤣而不敢✂作为。
建议将原创性【yuán chuàng xìng】🧑创新医疗器械【liáo qì xiè】纳入容错机制【cuò jī zhì】,建立“有条件😇放行制🆖度”,比如降📛低临床【dī lín chuáng】试验样本【běn】量要求和随【qiú hé suí】💙访周期,在安全🚸性和有【xìng hé yǒu】🚻效性得到初步🐸验证的基础上🚉,试行两年或三年有效期《试产注册证【cè zhèng】》制度【zhì dù】,在产品试产注册期间,设立一【shè lì yī】定条件【dìng tiáo jiàn】🚫,期满要【qī mǎn yào】🥅求企业提交更大样本【běn】🗓量的临【liàng de lín】㊙床验证数据,待大样【dài dà yàng】本【běn】🗓临床数【lín chuáng shù】据证实长期🗓的安全【de ān quán】性和有【xìng hé yǒu】🚻效性后,再给予💊批准五年效期的《产品注👸册证【cè zhèng】》。
优化完【yōu huà wán】🦏善专家评审机🐟制,强化审评人才队伍建【duì wǔ jiàn】设
1.完善评【wán shàn píng】审专家【zhuān jiā】🖕库。纳入更【nà rù gèng】多熟知细分行😦业领域技术发展方向【zhǎn fāng xiàng】的行业专家【zhuān jiā】,包括但🔫不限于科研院校教授【xiào jiāo shòu】和临床专♟家,如投资😇行业分析师🍃、龙头企【lóng tóu qǐ】业的研发专家【zhuān jiā】等;在创新【zài chuàng xīn】医疗器🕔械审评过程中📌,由于只🔋有参与过临床📰研究的专家【zhuān jiā】,才更加👜客观科【kè guān kē】🗻学认知【xué rèn zhī】产品安【chǎn pǐn ān】全性和有效性,否则难👒免有失偏颇【piān pō】,因此应【yīn cǐ yīng】规定参【guī dìng cān】与临床【yǔ lín chuáng】试验的临床专♟家须参【jiā xū cān】🈚与评价🧚。
2.优化专✒家咨询会🤡议制度【yì zhì dù】。进一步【jìn yī bù】完善《医疗器械技术【xiè jì shù】审评中【shěn píng zhōng】♿心专家咨询会🤡、专家公⤵开论证🐼会操作【huì cāo zuò】规范》,从会议【cóng huì yì】规模、专家结🗼构【gòu】、人员数【rén yuán shù】量、会议独【huì yì dú】📔立性和🛋决策有【jué cè yǒu】♎效性等【xiào xìng děng】方面进🧔行完善,确保专家咨询的🌤权威性、代表性和透明性。外聘专家审评或需与药品联【yào pǐn lián】合审评的🌤,所需时🍞间不超【jiān bú chāo】过器械【guò qì xiè】本身的🐘审批时【shěn pī shí】👉限。
3.进一步【jìn yī bù】强化审评人才😺队伍建设。加强审评中心人员自身的专业技术【yè jì shù】👕水平尤【shuǐ píng yóu】🥄其是临床学术🕐水平🐱,确保在⤵评审过【píng shěn guò】程中【chéng zhōng】,准确把♟握创新【wò chuàng xīn】产品的临床应用要点【yòng yào diǎn】和注册🏘法规要求🥍,科学评价产品【jià chǎn pǐn】的安全有效性【yǒu xiào xìng】。
加强评审部门与注册企业的双向沟通
尽可能再提高🈷沟通效率,缩短受🤶理前预【lǐ qián yù】约咨询🍈回复时间【jiān】🤪,更多地采用线👰下沟通交流方式。建立落🚤实技术【shí jì shù】😙审评向产品研发阶段【fā jiē duàn】🔞前移工【qián yí gōng】作机制,提前介🥃入⛅、研审联【yán shěn lián】动🔲,将审评标准与企业研发过程紧密融【jǐn mì róng】合,实现加【shí xiàn jiā】🦋速评审【sù píng shěn】。加强对企业指🌓导👡,在指导【zài zhǐ dǎo】👡过程中【guò chéng zhōng】,不仅要【bú jǐn yào】提出问题,更要帮助企业【zhù qǐ yè】⬆指明改进的方【jìn de fāng】向,强化审评共性【píng gòng xìng】问题答👰疑的梳【yí de shū】理、汇总和及时发布【bù】📟。
制定完善更多激励性措施
参考国【cān kǎo guó】内外好【nèi wài hǎo】🤘的激励【de jī lì】🏜措施,完善我国在审【guó zài shěn】评🏭方面的【fāng miàn de】对创【duì chuàng】🤴新的激励【de jī lì】🏜性制度,对纳入🚭创新申【chuàng xīn shēn】报绿色通道的产品【chǎn pǐn】🚂,在检验【zài jiǎn yàn】、审评和检查等环节【huán jiē】,真正做⛸到指导、流程、时效等方面的【fāng miàn de】优先优惠【huì】🦋,尤其是【yóu qí shì】🚪一些具有赶超【yǒu gǎn chāo】国际一流水平的创新器械【qì xiè】❎(如国外同类产🕗品已上市【shì】😵但尚未【dàn shàng wèi】进入我【jìn rù wǒ】国的,或者已获证但未有大量临床数据和【shù jù hé】经验的产品【chǎn pǐn】🚂),在审评🏭审批过【shěn pī guò】程中🦆,综合考虑难以获取试验数据的客观【de kè guān】实际情🏥况,给予一🍓些特殊政策【zhèng cè】,例如临床豁免🌀制度规定或分类简化临床试验环节【yàn huán jiē】🎻,缩短评审周期🔇,力争尽快获批上市【shì】😵,有效激发企业🔢参与创新医疗器械【qì xiè】❎研发的积极性,实现紧🈯跟国际【gēn guó jì】前沿创📱新和尽⚓早国产📖替代【tì dài】🕴。
进一步加强自主创新,推动产医融合
要提升🍼本土医【běn tǔ yī】🧢疗器械【liáo qì xiè】的创新【de chuàng xīn】研发实【yán fā shí】🚄力🐢,迫切需【pò qiē xū】要产业【yào chǎn yè】🎥与医院【yǔ yī yuàn】🔙强强联🎾手,如在智【rú zài zhì】慧医疗领域【lǐng yù】,将企业【jiāng qǐ yè】的算法与医院【yǔ yī yuàn】🔙的大数⬛据结合【jù jié hé】🔃,通过资【tōng guò zī】源共享,发展智能辅助🔺诊断系统👛;鼓励创【gǔ lì chuàng】🔨新企业🎑和医务🦒人员交叉挂职【chā guà zhí】,医生通过产学研深度、开放的🗻合作,协同科研团队【yán tuán duì】、企业工程技术人员、共同参与原创性科研💍,推动创【tuī dòng chuàng】新医疗【xīn yī liáo】器械临🎗床试验的积极开展和迭代升【dié dài shēng】😹级改进。对于国产创新【chǎn chuàng xīn】大型医【dà xíng yī】🐰疗设备【liáo shè bèi】🏕,选择若干省市、若干具💣备较高【bèi jiào gāo】👼科研和🚺临床水平的三【píng de sān】级医院【yuàn】🔙、专科医院【yuàn】🔙,设立研🐖究性医🥀院【yuàn】🔙、研究型👟病房,建设国🕤产创新【chǎn chuàng xīn】大型医【dà xíng yī】🐰疗设备【liáo shè bèi】🏕应用示【yīng yòng shì】范基地。通过优【tōng guò yōu】先科研立项和【lì xiàng hé】评审、提供启动经费【dòng jīng fèi】等,提高医疗机构应用国💬产大型医【dà xíng yī】🐰用设备【yòng shè bèi】积极性,并孵化🍟前瞻性的科研成果,有效推【yǒu xiào tuī】动产医转化。